안전성∙품질로 의사·환자 접근성 확대
 |
| △ aaaaasssssss.jpg |
(서울=포커스뉴스) 셀트리온이 개발한 바이오시밀러 램시마가 유럽 시장에서 오리지널 의약품 시장을 빠르게 대체하고 있는 것으로 나타났다.
26일 셀트리온에 따르면 지난 2013년 8월 유럽 31개국에서 램시마 판매를 동시에 허가 받았으며나라별로 오리지널 의약품의 특허만료일자가 달라 허가 당시 15개 국가에서만 판매를 시작했다.
그러나 지난해 2월 독일, 프랑스, 이탈리아, 스페인, 영국 등 유럽 주요 국가의 오리지널 의약품 특허가 만료되면서 유럽 내 램시마의 처방 환자수가 급증하고 있다.
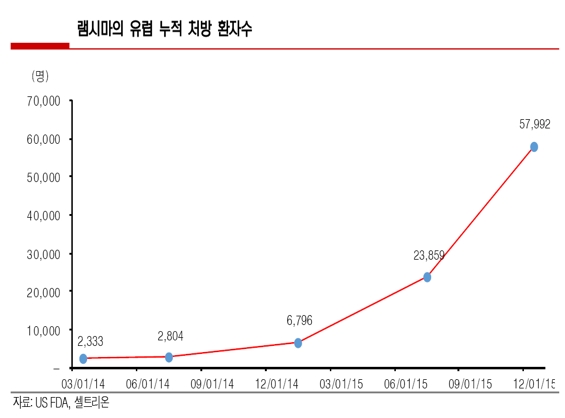
유럽 시장에 진출한 초기인 2014년 3월 경 램시마 처방 환자수는 약 2333명에 그쳤으나, 9개월이 경과한 12월에는 6796명으로 약 190% 늘어났다.
유럽 주요 국가 발매가 이뤄진 2015년에는 누적 처방환자 수 5만7992명으로 1년 동안 환자 수가 약 700% 이상 급증했다.
유럽 내 램시마의 오리지널의약품을 처방받는 자가면역질환자가 약 26만명으로 추산됨을 고려했을 때, 램시마가 이미 유럽 오리지널의약품 시장의 약 21% 이상을 잠식한 것이다.
셀트리온 관계자는 “램시마가 안전성과 품질, 오리지널의약품과의 동등성을 바탕으로 유럽 현지 의사와 환자에게 오리지널 의약품의 대체 의약품으로 큰 거부감 없이 처방되고 있다”고 말했다.
그는 “유럽 시장 본격 진출 첫 해에 기대 이상의 안정적 성장을 기록하고 있는 만큼, 세계 바이오의약품 시장의 50%를 차지하는 미국에서도 허가 이후 시장에 순조롭게 진입할 수 있을 것으로 예상하고 있다”고 설명했다.
셀트리온은 지난 2월 9일 미국 FDA 자문위원회를 통해 램시마의 판매허가를 권고받았으며, 오는 4월 FDA의 판매 허가 승인을 기다리고 있는 상태다.
이 관계자는 “하반기 미국 내 유통사인 화이자를 통해 미국 판매에 돌입할 경우, 사실상 올해가 셀트리온이 글로벌 바이오기업으로 성장하는 원년이 될 것으로 기대하고 있다”고 덧붙였다.<자료출처=셀트리온>
[저작권자ⓒ 부자동네타임즈. 무단전재-재배포 금지]